Neben molekularen Verbindungen und Salzen sind die Metalle eine große Stoffklasse in der Chemie. Molekulare Stoffe sind dabei ausschließlich aus Nichtmetallen, Salze hingegen aus Metallen und Nichtmetallen aufgebaut.
Eigenschaften von Metallen
Die Atome eines festen Metalls sind in einem sogenannten Metallgitter angeordnet. Einige der Elektronen der Metall-Atome sind relativ locker an den Atomkern gebunden, wodurch sie sich zwischen den positiven Metall-Atomrümpfen bewegen können. Da die Bewegung der Elektronen ähnlich wie Atome bzw. Moleküle eines Gases ist, werden die sich bewegenden Elektronen auch als Elektronengas bezeichnet. Zwischen den fest auf ihren Plätzen sitzenden positiven Atomrümpfen und den beweglichen Elektronen im Elektronengas herrschen Anziehungskräfte, die die sogenannte Metallbindung verursachen.
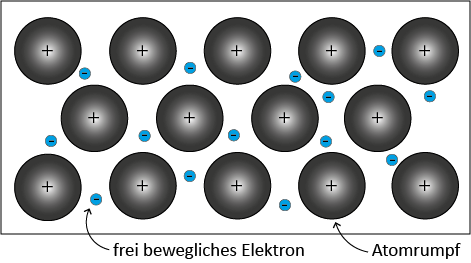
Eigenschaften von Metallen
Metallischer Glanz
Metalle besitzen einen typischen metallischen Glanz. Durch äußere Einflüsse kann dieser Glanz allerdings auch verloren gehen. Die Ursache für diesen Glanz liegt an der sehr glatten Oberfläche der Metalle, welche durch das Elektronengas verursacht wird. Die glatte Oberfläche reflektiert Licht besonders gut.
Duktilität
Bis auf das bei Raumtemperatur flüssige Quecksilber sind alle Metalle fest. Sie lassen sich aber biegen und brechen nicht wie Salze bei Druckeinwirkung spröde entzwei. Anders als bei Salzen können die Elektronen als Elektronengas den Atomrümpfen folgen, wenn diese verschoben werden. Dadurch treffen keine gleichnamigen Ladungen aufeinander.
Elektrische Leitfähigkeit
Metalle leiten elektrischen Strom auch in festem Zustand und werden deshalb als Stromkabeln eingesetzt. Salze hingegen leiten Strom nicht als Feststoff, sondern nur als Schmelze oder in Lösung. Für die elektrische Leitfähigkeit sind frei bewegliche Ladungsträger notwendig. In Metallen ist dies durch die frei beweglichen Elektronen des Elektronengases gegeben. Die Elektronen sind in ständiger, ungerichteter Bewegung. Sobald eine Spannung angelegt wird, bewegen sich die Elektronen Richtung Pluspol. Bei geschlossenem Stromkreis gelangen über den Minuspol neue Elektronen in die Metallportion und bewegen sich Richtung Pluspol.
Wärmeleitfähigkeit
Metalle leiten Wärme sehr gut. Aus diesem Grund besitzen Kochtöpfe häufig Griffe aus Kunststoff und nicht aus Metall. Eine erhöhte Wärmeenergie führt zu stärkeren Schwingungen der Atomrümpfe, die wiederum diese Schwingungen an die Elektronen des Elektronengases weitergeben. Diese beweglichen Elektronen können die Schwingungen wieder an andere Atomrümpfe, die weiter entfernt von der Wärmequelle liegen, weitergeben.
Teste dein Wissen
Teste dein Wissen zum Thema Metalle und Metalleigenschaften. Wie viele Fragen kannst du richtig beantworten?
Quelle H5P-Inhalt: eigene Erstellung
Literatur
[1] Hollweck, E. (Hrsg.). (2020). Chemie 8 NTG, Gymnasium Bayern. C.C.Buchner Verlag, Bamberg

