Die Löslichkeit zweier Stoffe ineinander hängt maßgeblich von den intermolekularen Wechselwirkungen der einzelnen Stoffe miteinander ab.
Löslichkeit molekularer Stoffe
Der Grundsatz
Die Löslichkeit von molekularen Stoffen beruht auf den molekularen Wechselwirkungen, die ausgebildet werden können. Dabei gilt der Grundsatz: „Ähnliches löst sich in Ähnlichem“ (lat. „Similia similibus solvuntur“).
Hydrophile und lipophile Stoffe
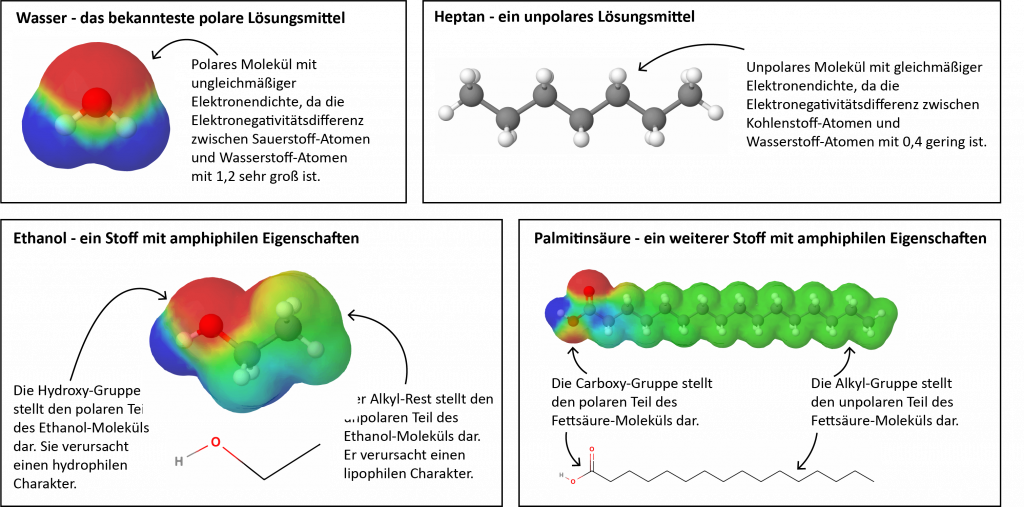
Polare Stoffe lösen sich dem Grundsatz zufolge gut in polaren Lösungsmitteln wie Wasser. Aus diesem Grund werden sie auch als hydrophile (von griech. „Wasser liebend“, aus ὕδωρ hýdor „Wasser“ sowie φίλος phílos „liebend“, „Freund“) Stoffe bezeichnet. Unpolare Stoffe hingegen lösen sich nicht in Wasser, sondern in unpolaren Lösungsmitteln, wie beispielsweise Benzin, Fetten oder Alkanen. Aus diesem Grund werden sie lipophile (von griech. „Fett liebend“, aus λίπος lípos „Fett“ und φίλος philos „liebend“, „Freund“) Stoffe genannt.
Hydrophile Stoffe sind automatisch lipophob (von griech. λίπος lípos „Fett“ sowie φόβος phóbos „Furcht“) und lipophile Stoffe automatisch hydrophob (von griech. ὕδωρ hýdor „Wasser“ sowie φόβος phóbos „Furcht“).
Amphiphile Stoffe
Einige Stoffe besitzen sowohl einen polaren als auch einen unpolaren Teil. Folglich sind Teile dieser Moleküle hydrophil und andere lipophil. Das Ethanol-Molekül beispielsweise hat einen polaren Teil (die Hydroxy-Gruppe) und einen unpolaren Teil (den Alkyl-Rest). Ethanol löst sich deshalb sowohl in polaren Lösungsmitteln wie Wasser als auch in unpolaren Lösungsmitteln wie Benzin gut. Solche Stoffe werden amphiphile Stoffe genannt (von griech. ἀμφί amphí „auf beiden Seiten“ sowie φίλος phílos „liebend“).
Überprüfe dein Wissen
Test dein Wissen mithilfe des Quiz.
Quelle H5P-Inhalt: eigene Erstellung
Literatur
[1] MolView: https://molview.org/ (Abgerufen am 20.08.2022)

