Die Synthese von Natriumchlorid aus den Elementen ist ein stark exothermer Prozess. Bei der Zugabe von Chlorgas zu einem zuvor erhitzten Natriumstück kann eine hell leuchtende Flamme und eine starke Wärmeentwicklung beobachtet werden. Der gesamte chemische Prozess kann in einzelne Schritte aufgeteilt werden. Damit kann der energetische Ablauf besser verstanden werden. Das Video zeigt eindrücklich die starke Reaktion dieser beiden Stoffe.
Reaktion von Natrium mit Chlor
Sowohl Natrium als auch Chlor sind Stoffe mit nicht zu unterschätzendem Gefahrenpotenzial. Natrium ist ein Metall, das sehr weich ist und sogar mit dem Messer geschnitten werden kann. Allerdings reagiert es sehr stark mit Wasser unter Wasserstoffentwicklung, weshalb man unbedingt wasserfrei mit Natrium arbeiten sollte. Chlor ist bei Raumtemperatur gasförmig. Es ist giftig und verätzt beim Einatmen die Atemwege. Bei entsprechend hoher Dosis ist es tödlich, weshalb es in den Weltkriegen auch als Kampfmittel eingesetzt wurde.
Betrachtet man die Reaktion von Natrium mit Chlor, so können einzelne Schritte der Reaktion betrachtet werden:
Übung 01: Beschreibe die einzelnen Schritte der chemischen Reaktion zur Synthese von Natriumchlorid aus Natrium und Chlor in eigenen Worten.
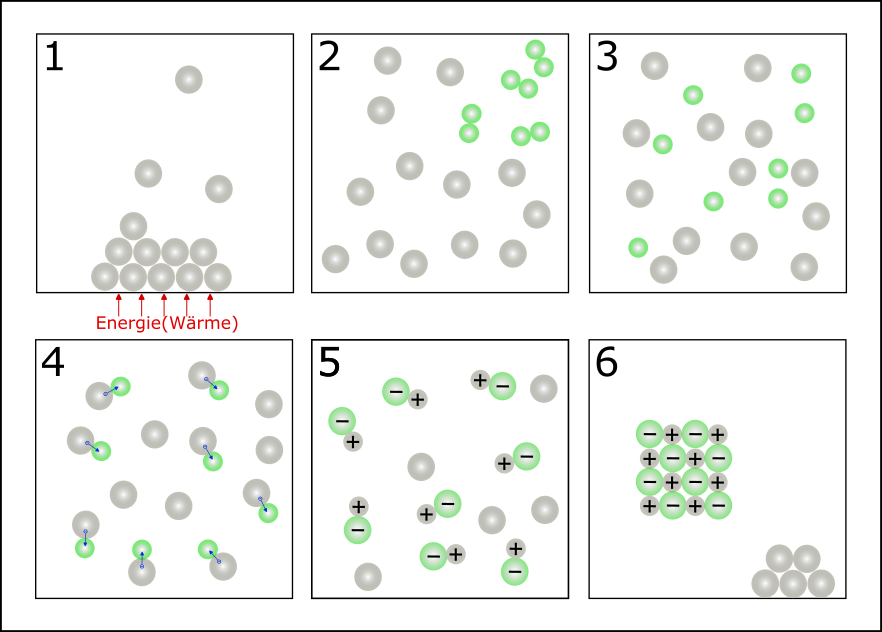
Quelle: eigene Erstellung/ verändert nach Chemie 9 NTG Gymnasium Bayern, C.C.Buchner [1]
Der Born-Haber-Kreisprozess
Max Born und Fritz Haber waren zwei Wissenschaftler, die 1916 unabhängig voneinander entdeckt hatten, dass der Reaktionsweg einer chemischen Reaktion keinen Einfluss auf die Reaktionsenthalpie einer Reaktion hat.[1] Die einzelnen Teilschritte einer Reaktion können damit einzeln betrachtet werden und ergeben in ihrer Summe die Reaktionsenthalpie, die zur Bildung des Produkts führt.
Zur besseren Veranschaulichung dieses Prozesses hilft ein Diagramm:
Übung 02: Ordne die Textbausteine den richtigen Feldern im Diagramm zu. Wiederhole die Übung, falls noch nicht alle Texte korrekt zugeordnet sind.
Quelle H5P-Inhalt: eigene Erstellung / verändert nach Chemie 9 NTG Gymnasium Bayern, C.C.Buchner [1]
Energie der Teilprozesse pro mol:[1]
- Reaktionsenthalpie: ΔiE = -411 kJ/mol
- Sublimationsenergie: ΔsubEm (Na) = 107 kJ/mol
- Dissoziationsenergie: ΔdissEm (Cl) = 122 kJ/mol
- Ionisierungsenergie: ΔIEm (Na) = 496 kJ/mol
- Elektronenaffinität: ΔEAEm (Cl) = -349 kJ/mol
Übung 03: Berechne den noch offenen Energiebetrag der „Gitterenergie“ mithilfe der gegebenen Energiebeträge des Kreisprozesses.
Literatur
[1] Hollweck, E., Weingand, T. (Hrsg.). (2021). Biologie 9, Gymnasium Bayern. C.C.Buchner Verlag, Bamberg
[2] The Nobel Prize: https://www.nobelprize.org/prizes/physics/1954/born/facts/ (Aufgerufen am 25.12.2023)
[3] The Nobel Prize: https://www.nobelprize.org/prizes/chemistry/1918/haber/facts/ (Aufgerufen am 25.12.2023)
[4] YouTube-Kanal Uni Mainz: https://www.youtube.com/watch?v=Cbi680W0pcY (Abgerufen am 21.12.2023)

