Wofür sind Oxidationszahlen gut?
Oxidationszahlen sind eine wichtige Hilfsgröße in der Chemie. Mit ihnen können Chemikerinnen und Chemiker erkennen, ob eine sogenannte Redox-Reaktion vorliegt. Redox-Reaktionen sind chemische Reaktionen, bei denen Elektronen übertragen werden. Mit den Oxidationszahlen lässt sich sogar die Anzahl der übertragenen Elektronen bestimmen und in Form einer Redox-Reaktionsgleichung übersichtlich darstellen. Oxidationszahlen können mit verschiedenen Methoden bestimmt werden und werden als römische Zahl über dem jeweiligen Atomartsymbol angegeben.
Redox-Reaktionen findest du überall im Alltag. Beispielsweise findet gerade im Akku deines Smartphones eine solche Redox-Reaktion statt. Batterien und Akkumulatoren basieren auf diesem Typ von Reaktion, bei der Elektronen übertragen werden. Auch Verbrennungen sämtlicher Art sind Redox-Reaktionen. Im Übrigen kommt sogar ein Teil des Begriffs von der Reaktion mit Sauerstoff: Der Begriff „Redox“ setzt sich nämlich aus den Worten „Reduktion“ und „Oxidation“ zusammen. Letzteres leitet sich von dem Element „oxigenium“, also Sauerstoff ab und bedeutete ursprünglich die Reaktion mit Sauerstoff. Heute wird der Begriff viel allgemeiner verstanden und meint grundsätzlich eine Abgabe von Elektronen und eine damit verbundene Erhöhung der Oxidationszahl. Die abgegebenen Elektronen müssen auch wieder aufgenommen werden, weshalb es eine mit der Oxidation gekoppelte Reduktion gibt. Eine Reduktion ist eine Aufnahme von Elektronen und ist mit einer Erniedrigung der Oxidationszahl verbunden.

Methode 1 oder die „anorganische Methode“
Die erste Methode basiert auf einigen Regeln, die wir strikt einhalten müssen, um die Oxidationszahlen von anorganischen Verbindungen schnell und einfach bestimmen zu können. Die Regeln sollten auswendig gelernt werden.
WICHTIG: Die Regeln werden streng hierarchisch abgehandelt. Das heißt, wenn sich zwei Regeln widersprechen sollten, hat die zuerst genannte eine höhere Gewichtung und muss eingehalten werden. Von der tiefer stehenden Regel wird in diesem Fall abgewichen.
| Regel | Beispiele |
|---|---|
| Atome von Elementen und Element-Molekülen haben die Oxidationszahl 0. | 0 0 0 0 Na Zn H2 O2 |
| Bei Atom-Ionen entspricht die Oxidationszahl der Ladungszahl. | +I +II +III -II -I Na+ Mg2+ Al3+ O2- Cl– |
| Die Summe der Oxidationszahlen aller Atome in einem Molekül ergibt 0. Die Summe der Oxidationszahlen aller Atome in einem Molekül-Ion entspricht der Ladungszahl des Molekül-Ions. | +IV -II +VI -II -III +I MnO2 SO42- NH4+ |
| Metall-Atome haben in Verbindungen immer positive Oxidationszahlen. | +I -I LiH |
| Fluor-Atome haben in Verbindungen die Oxidationszahl -I. | +I -I +IV -I HF CF4 |
| Wasserstoff-Atome haben in Verbindungen meist die Oxidationszahl +I. | +I -II H2O Ausnahmen: Metallhydride (z.B. LiH) |
| Sauerstoff-Atome haben in Verbindungen meist die Oxidationszahl -II. | +I -II Na2O Ausnahmen: Peroxide (z.B. H2O2), Sauerstofffluoride (z.B. OF2) |
| Chlor-, Brom- und Iod-Atome haben in Verbindungen meist die Oxidationszahl -I. | +I -I +I -I NaCl HBr |
Übung 01: Bestimme die Oxidationszahlen der folgenden Verbindungen. Anschließend kannst du deine Ergebnisse mit den Lösungen am Ende der Seite vergleichen.
N2, NH3, NO2, NO, H2S, H2SO4, Na2O2, CuO, Cu2O, HNO3, MnO4–
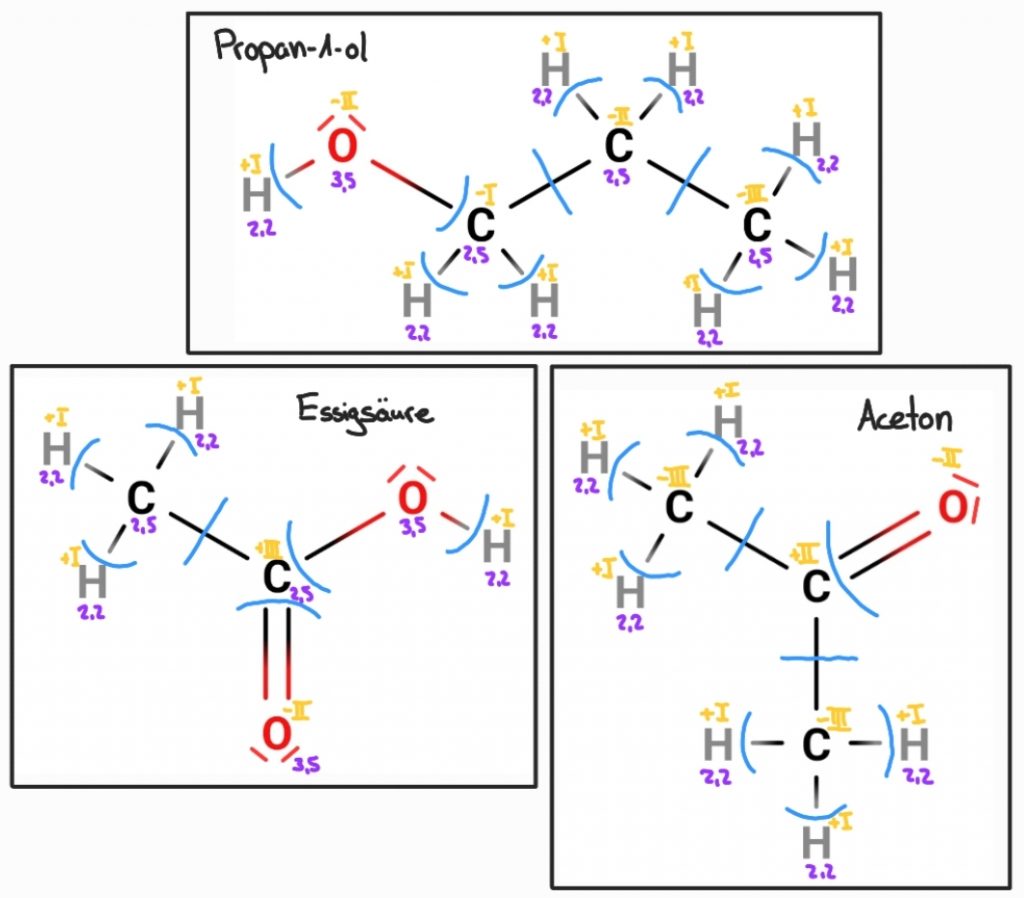
Methode 2 oder die „organische Methode“
Das folgende Video erklärt dir Schritt-für-Schritt die zweite Methode. Sie lässt dich Oxidationszahlen von organischen Molekülen individuell für jedes Atom bestimmen, ist allerdings etwas aufwendiger, weil wir zunächst die Valenzstrichformel formulieren müssen.
Übung 02: Bestimme die Oxidationszahlen der folgenden Verbindungen. Anschließend kannst du deine Ergebnisse mit den Lösungen am Ende der Seite vergleichen.
Propan-1-ol, Essigsäure (Ethansäure), Aceton (Propanon)
Lösungen zu den Übungsaufgaben
Literatur
[1] E. Hollweck, T. Weingand. Chemie 10 SG Gymnasium Bayern. C.C. Buchner, 2021.