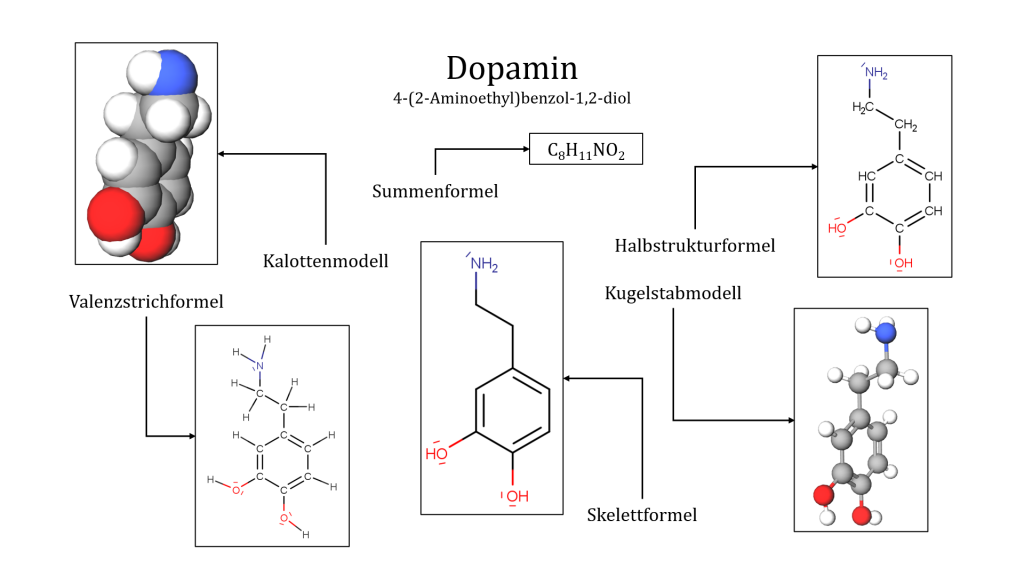
Die Darstellung von Molekülen ist für Chemiker:innen ein sehr wichtiges Hilfsmittel. Eine solche Darstellung entspricht allerdings nie vollkommen der Realität. Je nachdem, was genau dargestellt werden soll, können andere Formen eingesetzt werden. Deren jeweilige Vor- und Nachteile sollten bekannt sein, um sie richtig einzusetzen und interpretieren zu können. Die folgenden Darstellungsformen zeigen alle dasselbe Molekül: Dopamin (IUPAC: 4-(2-Aminoethyl)benzol-1,2-diol). Dopamin ist ein als „Glückshormon“ bekannter Neurotransmitter in unserem Körper.
Die Summenformel
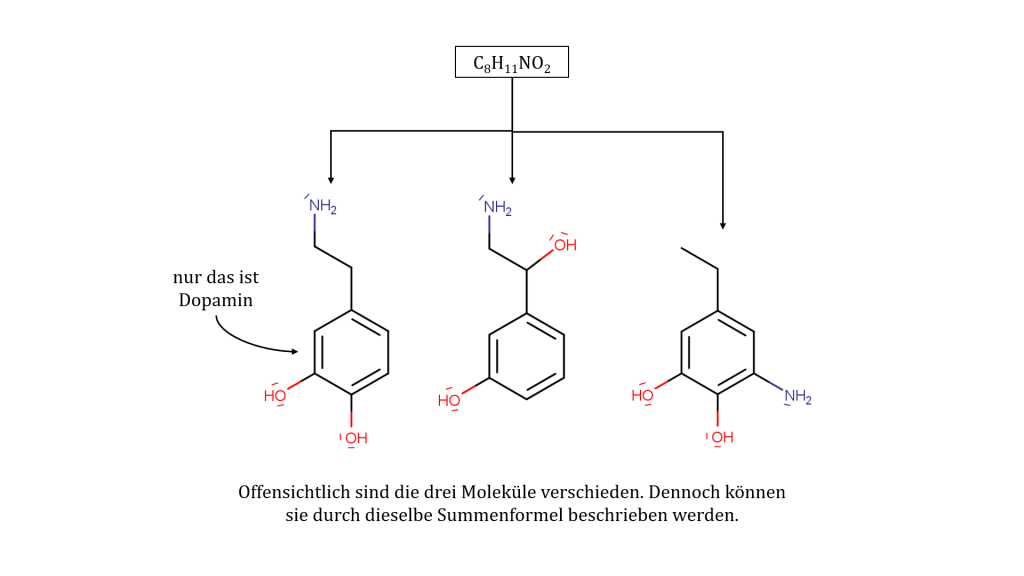
Die Summenformel ist eine der einfachsten Darstellungen für ein Molekül. Sie besteht aus den Atomartsymbolen der beteiligten Atome sowie der Anzahl der jeweiligen Atome durch die sogenannten Indizes. Indizes (Singular: Index) werden als tiefgestellte Ziffer geschrieben. Sie geben jeweils die Anzahl der Atome einer Atomart an und beziehen sich immer auf das Atomartsymbol, das direkt davor steht. Eine „1“ als Index wird weggelassen, da sowieso davon ausgegangen werden kann, dass ein Atom mindestens einmal vorhanden sein muss, wenn es in der Summenformel aufgelistet wird.
| Stärken | Schwächen |
|---|---|
| + einfache Darstellung + beteiligte Atomarten und deren Anzahl auf den ersten Blick ersichtlich | – verschiedene Moleküle können die gleiche Summenformel besitzen (vgl. Abbildung oben) – keine Rückschlüsse auf Struktur möglich |
Die Valenzstrichformel
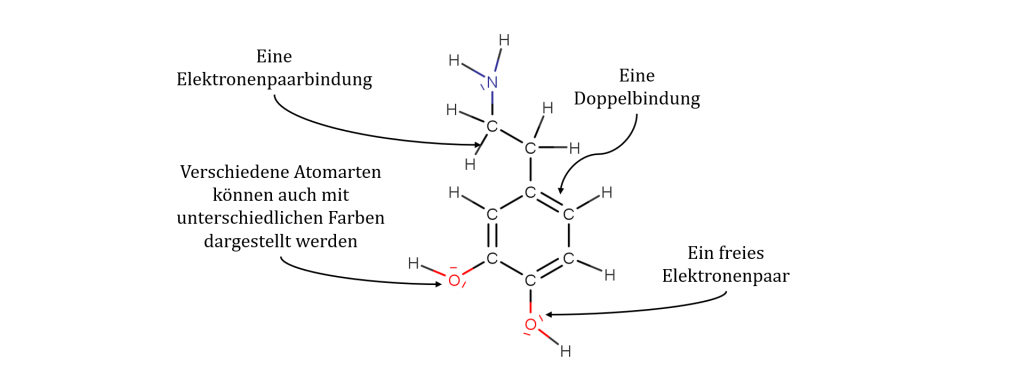
Mithilfe der Valenzstrichformel kann der Bau von Molekülen als 2D-Struktur dargestellt werden. Dabei werden alle Valenzelektronen (Elektronen der energiereichsten Energiestufe) eines Atoms berücksichtigt. Einzelne Elektronen werden als Punkte gezeichnet, Elektronenpaare hingegen als Striche. Jeder Strich steht dabei für ein Elektronenpaar, also für insgesamt zwei Elektronen. Elektronenpaare, die zwei Atomartsymbole miteinander verbinden, symbolisieren eine Elektronenpaarbindung, während Elektronenpaare, die an einem einzigen Atomartsymbol verortet sind, freie Elektronenpaare darstellen sollen. Auch Doppel- und Dreifachbindungen können gezeichnet werden.
| Stärken | Schwächen |
|---|---|
| + einfache Darstellung + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird ersichtlich | – keine Rückschlüsse auf 3D-Struktur möglich – für sehr große Moleküle aufwendig zu zeichnen, da jedes einzelne Atom und jedes einzelne Valenzelektron eingezeichnet werden muss |
Die Keilstrichformel
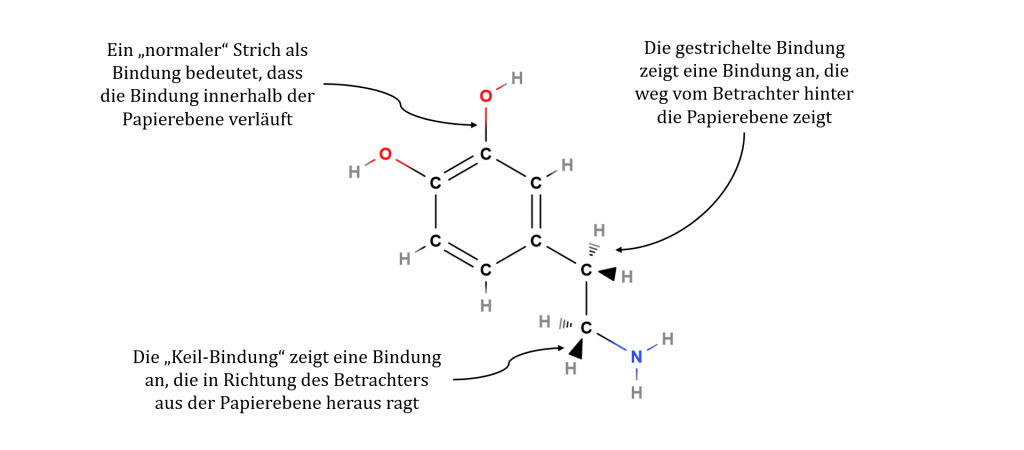
Die Keilstrichformel ist der Valenzstrichformel sehr ähnlich. Statt nur einfachen Strichen als Elektronenpaarbindung werden zwei weitere Darstellungsarten von der Elektronenpaarbindung verwendet. Ein Keil bedeutet, dass diese Bindung aus der Papierebene auf den Betrachter zu herausragt. Ein gestrichelter Keil wird als Bindung interpretiert, die hinter die Papierebene vom Betrachter weg ragt. Die altbekannten einfachen Striche werden als Elektronenpaarbindung in der Papierebene interpretiert.
| Stärken | Schwächen |
|---|---|
| + relativ einfache Darstellung + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird ersichtlich + Rückschlüsse auf 3D-Struktur hier möglich | – für sehr große Moleküle sehr aufwendig zu zeichnen, da jedes einzelne Atom, jedes einzelne Valenzelektron sowie alle Bindungsrichtungen, eingezeichnet werden müssen |
Die Halbstrukturformel
Die Halbstrukturformel vereinfacht einige Aspekte der Valenzstrichformel. Die Bindungen zu den Wasserstoffatomen werden nicht mehr separat gezeichnet. Die Wasserstoffatome werden lediglich zu dem Atom gezeichnet, an das es theoretisch gebunden ist. Bindungen, die das Rückgrat des Moleküls bilden, vor allem die Elektronenpaarbindungen zwischen Kohlenstoffatomen, werden weiterhin wie bei Valenzstrichformeln als Striche gezeichnet. Eine Kombination mit der Keilstrichformel ist möglich, um 3D-Aspekte zu berücksichtigen.
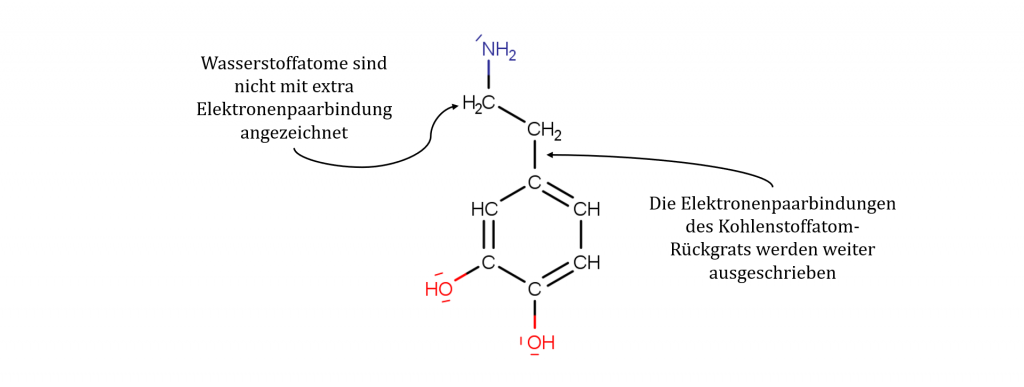
| Stärken | Schwächen |
|---|---|
| + einfache Darstellung + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird nach wie vor ersichtlich | – Rückschlüsse auf 3D-Struktur hier nur möglich, wenn als Keilstrichformel gezeichnet – für sehr große Moleküle nach wie vor aufwendig zu zeichnen, da jedes einzelne Atom und jedes einzelne Valenzelektron eingezeichnet werden müssen |
Die Skelettformel
Die Skelettformel vereinfacht viele Aspekte der Valenzstrichformel. Die Wasserstoffatome werden gar nicht mehr gezeichnet. Lediglich, um bestimmte zentrale Aspekte besser darstellen zu können, werden Wasserstoffatome noch gezeichnet. Kohlenstoffatome werden im Normalfall ebenfalls nicht gezeichnet. Sie werden durch Endpunkte und Ecken der gezeichneten Elektronenpaarbindungen symbolisiert. Weitere andere Atome werden separat gezeichnet.
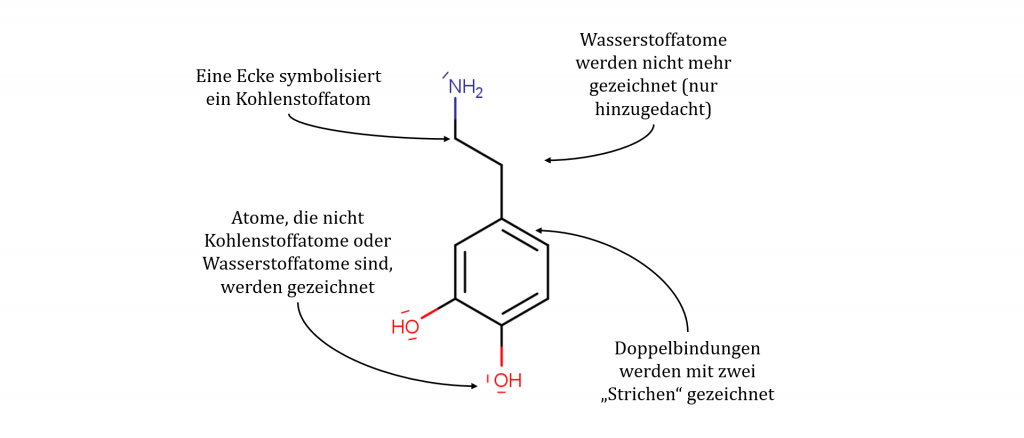
| Stärken | Schwächen |
|---|---|
| + sehr einfache Darstellung + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird nach wie vor ersichtlich | – Rückschlüsse auf 3D-Struktur hier nur möglich, wenn als Keilstrichformel gezeichnet – für sehr große Moleküle deutlich einfacher zu zeichnen, da nicht jedes einzelne Atom und jedes einzelne Valenzelektron eingezeichnet werden müssen |
Das Kugelstabmodell
Das Kugelstabmodell dient vor allem der 3D-Darstellung von Molekülen. Atome werden als Kugeln, meist in verschiedenen Farben, symbolisiert. Die Valenzstrichbindungen zwischen den Atomen werden als Stäbe eingezeichnet. Von Hand wird dieses Modell üblicherweise nicht gezeichnet. Es wird mithilfe von Computerprogrammen simuliert.
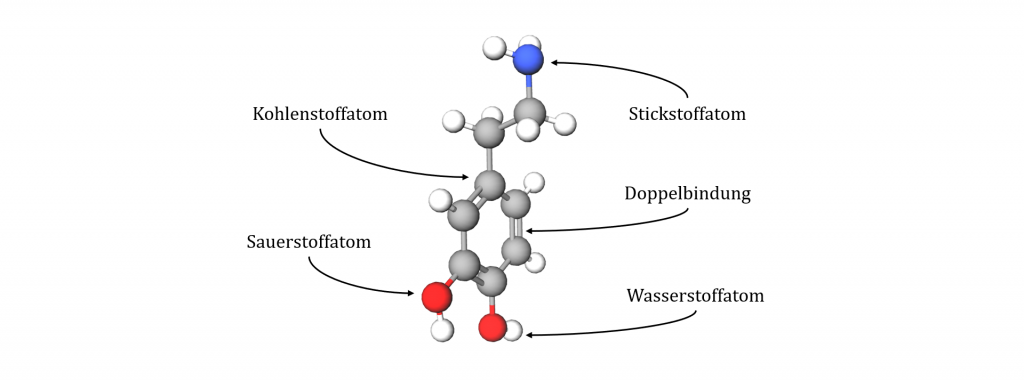
| Stärken | Schwächen |
|---|---|
| + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird nach wie vor ersichtlich + Rückschlüsse auf 3D-Struktur hier möglich | – aufwendigere Darstellung – für sehr große Moleküle nach wie vor aufwendig zu zeichnen, da jedes einzelne Atom eingezeichnet werden muss |
Das Kalottenmodell
Die Kalottenmodell dient vor allem der 3D-Darstellung von Molekülen. Im Gegensatz zum Kugelstabmodell werden Atome als sehr große Kugeln symbolisiert. Dabei soll die Oberfläche eines Moleküls dargestellt werden. Einzelne Atome sind nicht mehr in Gänze einzeln zu erkennen, weshalb auch keine Elektronenpaarbindungen sichtbar sind. Auch hier werden verschiedene Atomarten mit verschiedenen Farben dargestellt. Von Hand wird dieses Modell üblicherweise nicht gezeichnet. Es wird mithilfe von Computerprogrammen simuliert.
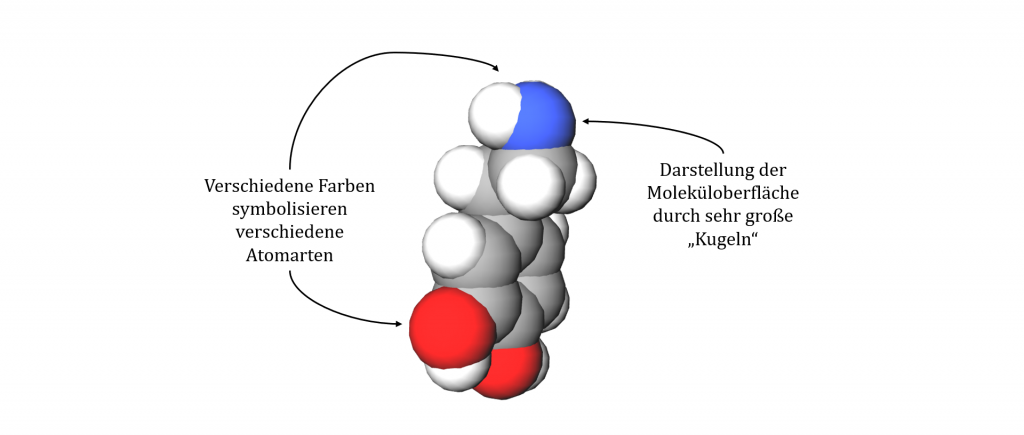
| Stärken | Schwächen |
|---|---|
| + Konstitution (Menge und Art der Bindungen zwischen beteiligten Atomen) von Molekülen wird nach wie vor ersichtlich + Rückschlüsse auf 3D-Struktur hier möglich | – aufwendigere Darstellung – für sehr große Moleküle nach wie vor aufwendig zu zeichnen, da jedes einzelne Atom eingezeichnet werden muss |
Literatur
[1] 3D-Moleküldarstellungen: https://molview.org/ (Abgerufen am 26.08.2023)
[2] Formeldarstellungen: https://chemaxon.com/marvin (Abgerufen am 26.05.2023)

